Анализът на това как клетките усещат и разпространяват физически сили води до вълнуващи нови средства и открития в механобиологията и механомедицита.
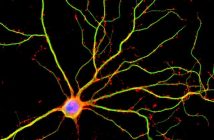
 КЛЕТЪЧНО СКЕЛЕ: Това микроскопско изображение със супер-резолюция показва актин в жива свинска бъбречна клетка.
КЛЕТЪЧНО СКЕЛЕ: Това микроскопско изображение със супер-резолюция показва актин в жива свинска бъбречна клетка.
Добре е известно, че някои човешки заболявания са свързани с промени в механичните свойства на тъканите. При пациенти, страдащи от атеросклероза, артериите губят част от своята еластичност и стават по-дебели и по-твърди. При чернодробна или белодробна фиброза прекомерната фиброзна съединителна тъкан има подобен втвърдяващ ефект върху тези органи. А пациенти с аневризми имат издутини като балон в кръвоносните съдове, които, ако не се лекуват, може да се разширяват под действие на налягането, докато не се пръснат.
Разбира се, механичните свойства и сили не са важни само при болест, но и в здраве. Почти всички живи клетки и тъкани проявяват и изпитват физически сили, които влияят върху биологичната функция. Величините на тези сили варират между различните видове клетки и тъкани, както и чувствителността на клетките към промените на величина, честота и продължителност на силите. Допир, слух, проприоцепция и някои други сетива са добре известни примери за специализирани сензори за сила. Но усещането за силата не се ограничава само до тези специални случаи; по-скоро те са споделени от всички живи клетки във всички тъкани и органи. Подлежащите механизми на генериране и детектиране на сила не са добре установени, оставяйки много отворени въпроси за динамиката на силата; разстоянието, на което една сила упражнява своето въздействие; и как клетките превръщат механичните сигнали в биохимични и какви са промените в генната експресия.
През последните години биолозите са започнали да разкриват молекулните агенти, които посредничат за усещане на приложената сила и разпространението на сигнала на клетъчно ниво, и събират информация за това как механичните въздействия влияят на биологичната функция. Това знание може да проправи пътя за по-доброто разбиране на това как физическите сили влияят върху биологичните функции при ембрионалното развитие, нормалната физиология, както и при сложни заболявания. Прилагането на тези познания в клиничната практика може да помогне за създаването на нови начини за лечение на някои заболявания с помощта на механично- и инженерно-базирани способи.
Генериране и усещане на физически сили
В началото на 80-те години, Доналд Ингбър от Харвардския университет и Мина Бисел от Lawrence Berkeley National Laboratory независимо предлагат, че извънклетъчния матрикс (ЕСМ), която обгръща и поддържа клетките, би могла да повлияе на организацията и функцията на клетките и тъканите, както и на генната експресия. Но по онова време експерименталните доказателства са оскъдни, а механизмът е неясен.
През следващите години, изследователите започнаха да съобщават, че клетките усещат механични стимули чрез рецептори на клетъчната повърхност. През 1986 г. Ричард Хайнс и колеги от MIT клонирали един такъв рецептор, нарича интегрин, който се оказал основната трансмембранна молекула, която посредничи на клетъчната адхезия към ECM. Повечето изследователи тогава са предполагали, че интегрините (сега има 24 известни подтипа) участвали предимно в химическата сигнализация. Но в началото на 1990 г., докато работел като пост-докторант в лаборатория Ingber, Ning Wang осигурил първото експериментално доказателство, че интегрините, както и свързаните вътреклетъчни протеинови комплекси, известни като фокални адхезии, посредничат за механично предаване на сила към цитоскелета.
Използвайки магнитни гранули покрити с пептиди (изградени от аргинин, глицин и аспартат), които групират интегрини и индуцират образуването на фокални под перлите върху вътрешната повърхност на клетъчната мембрана, той прилагал различни налягания към повърхностите на живи клетки и установил, че ригидността на клетката се увеличава с увеличаване големината на приложените сили. Чрез разрушаване на цитоскелетни нишки, като филаментозния актин (F-актин), предаването на силата в клетката се преустановявало. Това проучване промени научната гледна точка за интегрините, които сега са признати като ключови сензори за молекулни сили.
Впоследствие, с помощта на лазерни пинсети, лабораторията на Mike Sheetz в Колумбийския университет независимо потвърди, че фокални адхезии предават външни сили към клетката. В допълнение, два други екипа – на Yu-Li Wang, сега в университета Карнеги Мелън, и Бени Гейгър от научния институт Уайзман – установили, че фокалните адхезии също предават сили, генерирани вътре в клетката чрез мощни молекулни мотори като миозин II, който се свързва с F-актин. Това изследване показва, че трансмисията на механични сигнали, посредством фокална адхезия, е двупосочна.
Друг клас механосензори, използвани от клетката, са активирани чрез йонни канали, които се активират при разтягане на плазмената мембрана. През последното десетилетие, Мартин Шалфи от Колумбийския университет и други лаборатории са работили по няколко кандидати за канали, които в отговор на разтягане, се отварят, за да позволят на йоните да се вливат в цитоплазмата. Резултатът е механоелектрическа трансдукция – аналог на невронално действие – която може да активира ензими или белтъци в цитоплазмата, за да повлияе на вътреклетъчни дейности, или дори да повлияе на генната експресия. Подробните механизмите за това, обаче, са все още неясни.
Напоследък много лаборатории търсят вътреклетъчни механосензори при фокалните адхезии. Например, Шийтс и колегите му са открили доказателства за механосензорната роля на фокално адхезния протеин талин, докато екипът на Мартин Шуорц в Йейл е демонстрирал подобна роля за протеина винкулин. Но един фундаментален въпрос остава: Как една жива клетка интегрира сили, усетени от различни механосензори и отговоря по последователен начин?
Ingber първи предлагат модела на тенсегрити (tensegrity – от tension, обтягане, integrity, цялостност) при клетките в началото на 1980 г., подчертавайки значението на напрежението в цитоскелетните структури за способността на клетката да получи цялостно усещане за приложените сили. Ако има напрежение в цитоскелетните влакна, то локална промяна в една част на влакното бързо се предава към всички свързани части.
Експериментални данни вече подкрепят този модел. В началото на 2000 г., в сътрудничество с лаборатория Ingber, екипът на Ning Wang използвали химикали, които ту да съкращават, ту да отпускат цитоскелета на култивирани човешки гладки мускулни клетки, което систематично варирало „вроденото” напрежение (или „предварително напрягане”) на клетките, без да се променя формата им. Те открили, че ригидността на клетките се променя съответно. С други думи, ригидността клетка се определя от напрежението на цитоскелета. Освен това, след разрушаване на микротубулите на клетката със специфични вещества, екипът установил, че силата, която се предава от клетката на околните структури, се повишава. Това предполага, че микротубулите, които са относително твърди компоненти от цитоскелета, по същество балансират част от ендогенното предварително напрягане на клетката, и когато са нарушени, това напрежение се прехвърля към ЕСМ.
Механотрансдукция на разстояние
В продължение на много години, преобладаващото мнение в областта на механотрансдукцията беше, че силите се предават само на кратко разстояние в живите клетки, и по този начин локално приложена сила може да упражнява ограничен ефект в периферията на клетката. От гледна точка на науката за материалите, този ограничен обхват би имал смисъл, ако материалът е хомогенен и изотропен – с други думи, няма разлика в своята твърдост или други механични свойства, когато посоката на силата се променя. В този случай, локалният стрес бързо ще изчезне с увеличаване на разстоянието. Въпреки това, цитоплазмата на живата клетка не е нито хомогенна, нито изотропна; тя е хетерогенна и анизотропна, което означава, че механичните свойства на материала зависят от посоката на силата. От голямо значение са твърдите, предварително напрегнати актинови „пакети” (наричани стрес влакна) в клетката. Приложените сили се концентрират в тези актинови снопове и се разпространяват на по-големи разстояния в цитоплазмата.
От началото на 2000 г., екипът на Wang е демонстрирал, че силите се разпространяват на относително големи клетъчни разстояния – от порядъка на десетки микрометри – в живите клетки, и този сигнал за дълго разстояние зависи от „вроденото” напрежение в цитоскелета. Също както струната на цигулка може да свири само с правилния резонанс и да свири правилната нота само при правилен натиск, когато предварително напрегнатите актинови снопчета са разстроени, предаването на силата става с малък обсег (действа само върху площ от няколко микрона). Колкото по-високо е напрежението, толкова по-далеч ще бъде разпространена силата.
Съвсем наскоро открихме, че специфични сигнални молекули – в частност тирозин киназа Src и ГТФаза RAC1 – могат да бъдат активирани на разстояние повече от 60 микрона от мястото на прилагане на локалната сила чрез интегрини в мембраната на клетката. Това активиране е бързо, отнема по-малко от 300 микросекунди от прилагане на силата до активиране на Src и RAC1, което прави механотрансдукцията много по-бърза от 10 до 20-те секунди, необходими на сигнал, индуциран от разтворим растежен фактор, да измине същото разстояние.
Механотрансдукция в ядрото
За разлика от нововъзникващата картина на разпространяване на силата в цитоплазмата, ние знаем много малко за ядрената механотрансдукция. Ядрената обвивка е физически свързана с актиновия цитоскелет чрез LINC комплекс (свръзката на нуклеоскелета с цитоскелета). В края на 1990 г., Ingber и колеги публикуваха първото доказателство, че от плазмената мембрана до ядрото достигат връзки, които предават силата и може би играят роля в регулирането на генната експресия. С помощта на микропипета, покрита с фибронектин, за да се прикрепя към повърхността на клетката, изследователите издърпали клетката и установили, че ядрената обвивка се е нарушила. По-късно, екипът на Wang разкрил дисоциация между протеини вътре в ядрото, предизвикана от прилагането на сила. Тази промяна зависела от правилно напрегнат цитоскелет и непокътната ядрената ламина – слой от междинни протеини, наречени ламини, наредени от вътрешната страна на биламеларната ядрена обвивка. Последващи изследвания са доказали, че ламините са много важни механосензори за диференциацията, опосредствана от ригидността на извънклетъчния матрикс, както и за регулацията на транскрипционни фактори.
За да се изследва по-директно дали съответна физиологична сила може директно да деформира структурата на хроматина в жива клетка за регулиране на специфична генна експресия, екипът на Wang наскоро си партнира с лабораторията на Andy Belmont от Университета на Илинойс в Урбана-Шампейн. Екипът на Belmont използва бактериални изкуствени хромозоми за вмъкване на няколко зелени флуоресцентни протеина и гена за дихидрофолат редуктаза (DHFR), основен ензим за синтез на тимин, в същата хроматинова област в клетки от яйчник на китайски хамстер (СНО). Лабораторията на Wang прилага локална сила на тези модифицирани клетки чрез интегрини. Разбира се, те измерили увеличението на транскрипцията на DHFR в отговор на приложената сила. Обратно, отстраняването на цитоскелетното напрежение, или с други думи – нарушаването на пътищата за предаване на сила от повърхността на клетката до ламините и до ядрените структурни протеини, свързани с хроматина, прекратили експресията на DHFR, предизвикана от прилагането на сила.
Тази работа предоставя първото доказателство, че външно приложени сили могат да разтягат хроматина и да насърчават генната експресия. Както се очакваше, отговорът бил бърз; екипът бил в състояние да определи количествено възходящата регулация на транскрипцията на DHFR в рамките на 15 секунди след прилагане на силата. Интересното е, че транскрипцията, задействана от сила, е чувствителна към ъгъла и посоката на силата по отношение на връзките с актина. Тъй като в живата клетка непрекъснато се генерират ендогенни сили, тези резултати показват, че генната експресия може да бъде непрекъснато регулирана от физически сили чрез този директен структурен път и непреки пътища на ядрената транслокация на някои фактори, като YAP и TWIST1, зависеща от ригидността на матрикса. Необходими са още изследвания, за да се разбере относителният принос на всеки един от тези механизми при определяне на общите нива на генна експресия в дадена клетка.
От механобиология към механомедицина
Механобиологията става все по-значима за биологията на стволовите клетки. В продължение на много години, учените са култивирани клетки върху твърди пластмасови или стъклени покривни стъкла. Добре е известно, че различните видове живи клетки в меките тъкани се прикрепват към матрици с различна твърдост. Настройвайки субстратната твърдост по контролиран начин, Yu-Li Wang и колеги показват, че размерът и динамиката на фокални адхезионни комплекси, както и миграцията на живи клетки, значително се променят при субстрати с различна твърдост. По-късно Адам Енглър от Университета на Калифорния, Сан Диего, и Денис Дишър на Университета в Пенсилвания, съобщиха, че диференциацията на мезенхимните стволови клетки може да бъде контролирана от твърдостта на извънклетъчния матрикс. А лабораторията на Ning Wang е показала, че прилагането на локална сила може да стимулира диференциацията на ембрионална стволова клетка. Физическите сили също се явяват важни в организацията на зародишните слоеве по време на ранното развитие на плода при бозайниците.
Изследователите също така взимат предвид механичните сили при изследвания на раковите заболявания. Например, въпреки десетилетията проучвания, все още не е ясно защо само няколко ракови клетки от хиляди са в състояние да метастазират. Отговорът може би е във физическата среда на тумора. Учените са показали, че в първични тумори, високото механично напрежение и твърдостта на матрикса са важни за развитието на рака. Въпреки това, вторичните метастазни области на туморите изглеждат по-меки.
Използвайки 3D мека матрица, изработена от фибринови гелове, екипът на Ning Wang успял да изолира и отгледа клетки, които са силно туморогенни и злокачествени, наречени tumor-repopulating cells (TRCs), от няколко миши или човешки ракови клетки. Интересното е, че меланомните TRCs, култивирани на меки 3D матрици, са по-малко диференцирани – и по-туморогенни – от меланомни клетки, отгледани на твърди матрици или върху твърда пластмаса, което предполага, че ниската матрична твърдост кара TRC да растат. Тези меко-култивирани меланомни TRCs също излизат от кръвоносните съдове при рибата зебра към вторични места за заселване (метастазиране) по-ефективно, отколкото по-диференцираните клетки на меланома, култивирани върху твърда повърхност. Тези открития предполагат една обща нишка в метастатичната колонизация на злокачествени тумори: няколко туморогенни клетки са способни да оцелеят, метастазират и растат в меките матрикси на вторичните области, защото тези клетки са недиференцирани.
А ролята на физическите сили в биологията не е по никакъв начин ограничена до биологията на стволовите клетки и рака. Из науките за живота, изследователите продължават да разчитат на прозрения в механобилогията, за да разберат и лекуват по-добре широк спектър от състояния. Механомедицината е на път да се превърне в един вълнуващ клон на медицината, който използва принципи и технологии на базата на механиката и инженерството за прецизна диагностика и ефективни терапии на заболявания, които са извън обсега на съществуващите способи.
Превод: Гергана Димитрова
Източник: The Scientist