Приучаването на имунната система да спре да напада собствените тъкани на организма би подобрило състоянието на пациентите с автоимунни заболявания, но клиничният напредък в тази посока е малък.
Историята често се повтаря. Преди повече от 100 години един от най-значимите имунолози в света, нобеловият лауреат Паул Ерлих, се съмнявал в съществуването на автоимунност, при която имунната система започва да атакува здрави тъкани. Представяйки си кошмарен сценарий, в който тялото се обръща срещу себе си, Ерлих смята, че това би било много малко вероятно да се случи. Неговият скептицизъм относно този феномен, наречен от него „horror autotoxicus” (буквално – „ужасът на самоотравянето”), забавил приемането на тази концепция с още половин век – въпреки убедителните клинични примери за полудяла имунна система.
След век научни изследвания, учените вече приемат, че автоимунността наистина съществува, а последствията от нея са разрушителни. Установени са над 20 автоимунни заболявания; те засягат всеки орган в тялото и около 50 милиона души в Северна Америка и Европа. Но изследователите в областта отново се сблъскват със съпротива – този път от страна на фармацевтичната индустрия, която ненавижда идеята да инвестира в по-насочен подход за лечение на тези пациенти.
Повечето автоимунни заболявания се характеризират с атака на конкретна система в организма: главният и гръбначният мозък се възпаляват при множествената склероза, ставите се израждат при ревматоидния артрит, а червата страдат при болестта на Крон и язвения колит. В някои случаи автоимунното заболяване засяга само един конкретен вид клетки или един орган. При диабет от тип 1 се разрушават или тежко се увреждат произвеждащите инсулин бета-клетки, разположени в Лангерхансовите островчета на задстомашната жлеза. Тази особеност на автоимунния отговор е резултат от имунна реактивност към конкретни собствени антигени. Ако изследователите успеят да идентифицират и да се прицелят в тези антигени, теоретично те биха могли да разработят лечения, които да „ударят заболяването в сърцето”.
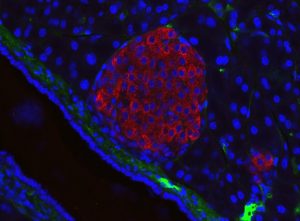
Лангерхансов остров при мишка. Инсулин – червено; ядра на клетките – синьо. Credit: Jakob Suckale (CC BY-SA 3.0)
Подобен прецизен подход би превъзмогнал много сериозен проблем със съвременните лечения на автоимунните заболявания – обикновено те са насочени към важни компоненти на имунната система, което прави пациентите податливи на инфекции, с които имунната им система по принцип би се справил. В клинично изпитване във фаза 3 на инхибитор на Янус-киназа (Janus-kinase) наречен барицитиниб (baricitinib), който блокира ключови биохимични пътища, включени в производството на молекули на възпалителния отговор, лечението потиснало симптомите на ревматоиден артрит, но пациентите започнали да страдат два до четири пъти по-често от херпес Зостер, в зависимост от дозата, в сравнение с контролната група. Аналогично, едно антитяло срещу адхезивна молекула, подобна на велкро и наречена α4 интегрин, която участва в насочването на лимфоцитите към мозъка, се е оказало ефективно при лечение на пристъпите на множествената склероза. Но този подход носи риска от фатална инфекция на мозъка, известна като прогресивна мултифокална левкоенцефалопатия (PML). Досега има повече от 500 случая на PML при пациенти, които са приемали антитялото срещу α4 интегрин, наречено натализумаб (natalizumab или Tysabri), като средната честота е 1 на 250, а рискът се увеличава с всеки допълнителен месец на прием на лекарството след година. Терапиите, които са насочени само към тези имунни клетки, които атакуват засегнатата тъкан при дадено автоимунно заболяване, биха позволили на останалите компоненти на имунната система, включително тези, които се борят с инфекциите, да вършат спокойно своята работа.
Но този подход, наречен антиген-специфична терапия, все още не е достатъчно популярен. Част от проблема е, че за много автоимунни състояния просто не знаем кои точно са антигените, които се разпознават и атакуват от имунната система. Въпреки че изследователите са идентифицирали тези молекули за няколко автоимунни заболявания, фармацевтичната индустрия не е склонна да инвестира в антиген-специфични терапии. Досега никой не е постигнал успех с този подход и затова подобни опити се възприемат като „непотвърдени” от индустрията. Липсата на подкрепа от фармацевтичната индустрия от своя страна забавя процеса на валидиране (потвърждаване) на тези насочени терапии. Антиген-специфичните терапии рядко са били изпитвани върху хора, а провалите в клиничните проучвания, изпитващи антиген-специфични терапии срещу множествената склероза, при която все още нямаме убедително знание за това кои са ключовите антигени, движещи развитието на заболяването, хвърлят още по-голяма сянка над способността ни да се прицелим в корена на автоимунното заболяване.
Този начин на мислене възпрепятства ефективното разработване на лекарства за автоимунни заболявания, в сравнение с терапевтичния напредък при много други нарушения, при които стандартите на лечение сега включват атака на специфични посредници на патогенезата. Например, в областта на алергиите имунната десенсибилизация към конкретния алерген е приета медицинска практика. Дори при толкова сложни заболявания, каквито са определени видове рак, изследователите успешно са се прицелили в причинителя на бързия растеж на раковите клетки. Иматиниб (Gleevec) е експериментално лекарство. То атакува хроничната миелогенна левкемия директно в точката на мутацията, която причинява смъртоносния рак.
Подобни насочени терапевтици могат да бъдат считани за това, което Ерлих нарича „магически куршуми”. За автоимунните заболявания нямаме такъв магически куршум. Разработването на терапия, която да изключва фундаменталните имунни пътища, които причиняват заболяването, изостава значително зад други подходи, които атакуват жизненоважни компоненти на нормалния имунен отговор. Наистина, на пазара няма терапии, които целят блокирането на имунните отговори, които стоят в самата основа на болестта, а само няколко (за диабет от тип 1) са успели да се придвижат до първите етапи на клинични изпитвания.
Диабет
Диабетът от тип 1 е основно автоимунно заболяване, което е готово да бъде атакувано с магически куршум. В момента единственият начин за поддържащо лечение е инсулинът – пептиден хормон, чиято роля е поддържането на хомеостазата (равновесието в организма) на глюкозата и е открит преди век. Въпреки че спасява живота на страдащите от това заболяване, инсулинът не предотвратява дългосрочните и коварни аспекти на заболяването, като инфаркт, инсулт, невропатия, бъбречни усложнения и заболявания на ретината. Но имунните отговори, които стоят зад това широко разпространено заболяване, са добре характеризирани: както антитела, така и цитотоксични Т-клетки убийци нападат молекули, които се произвеждат само от панкреатичните бета-клетки, в които нормално се синтезира инсулинът. Сега, два изследователски екипа атакуват фронтално тези аномални имунни отговори, като има обещаващи резултати в ранните етапи на клиничните проучвания.
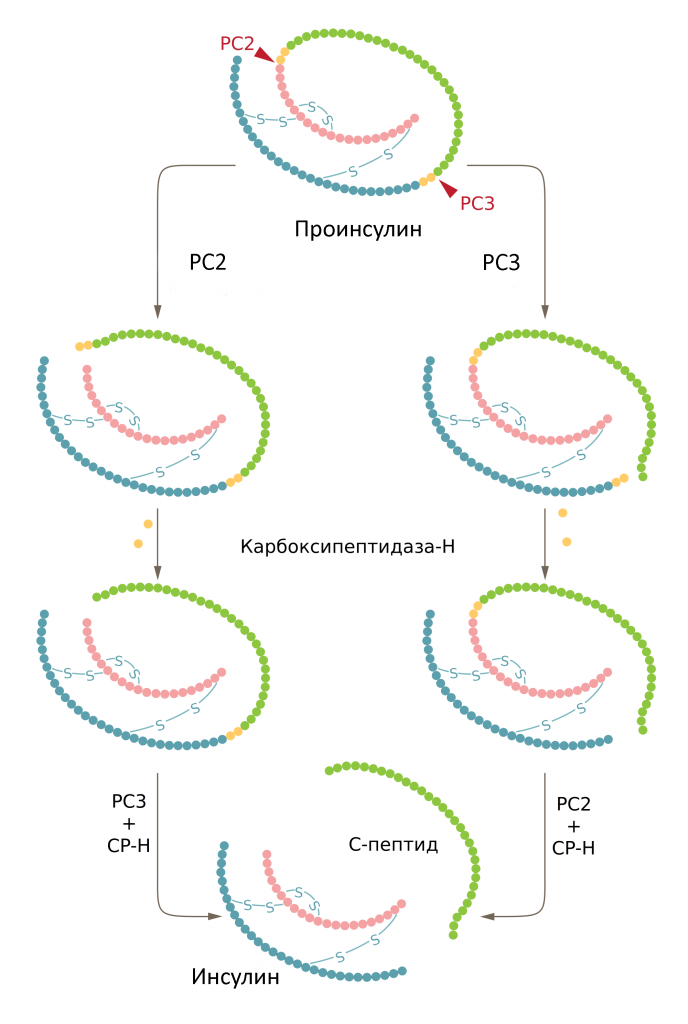
Един бета-клетъчен антиген (наречен автоантиген), срещу когото е насочено лечението на диабет тип 1, е проинсулинът – полипептиден предшественик (прекурсор) на инсулина. В проучване от 2004 изследователите са проследили състоянието на деца още от раждането им и са установили, че появата на антитела с висок афинитет към проинсулин корелира с развитието на диабет тип 1. За да направят организма на пациентите толерантен към собствения си проинсулин и да потушат неуместния имунен отговор, изследователите са създали ДНК плазмид (малка кръгова молекула ДНК, която носи определени гени), който кодира проинсулина. Некодиращата ДНК в скелета на плазмида съдържа естествени хексануклеотидни мотиви, които стимулират имунитета и се наричат CpG-последователности. Учените поставили CpG-последователностите до потискаща хексануклеотидна последователност, наречена GpG-последователност, за която се знае, че потиска имунния отговор. В плазмида е вграден и интрон, който да повиши експресията (производството) на проинсулин, след като плазмидът се инжектира в мускул.
Предклиничните изследвания на NOD-мишки (nonobese diabetic), които спонтанно развиват диабет тип 1, показват, че тези плазмиди успешно потискат автоимунния отговор и възстановяват нормалния метаболизъм на глюкозата. Плазмидът прави това като индуцира експресията на проинсулина от антиген-представящи клетки, като макрофагите и мускулните клетки, без обичайната ко-стимулация на Т-клетките. За да активира Т-клетките и да генерира имунен отговор, антиген като проинсулина трябва да бъде представен на Т-клетка от антиген-представяща клетка в присъствието на множество други молекули, наречени ко-стимулиращи молекули, като CD80 и CD86. Чрез експресията на проинсулин без ко-стимулация, плазмидът води до имунна толерантност. След мускулни инжекции на плазмида, имунният отговор към проинсулина при NOD-мишките се потиска. Това води до възстановяване на глюкозната хомеостаза, намаляване на възпалението на Лангерхансовите островчета и намаляване на антителата, насочени срещу клетките в островчетата.
С тези предклинични резултати в ръка, учените основали биотехнологичната компания Tolerion, за да спонсорират клинични изпитвания на плазмида при 80 души в САЩ, Австралия и Нова Зеландия. Всяка седмица в продължение на 12 седмици участниците били инжектирани или с плазмида, кодиращ проинсулин, или с плацебо. Първата главна цел на изпитването, което е приключило през 2012, била да се измери количеството на C-пептида – участък от молекулата на проинсулина с дължина 31 аминокиселини, който се изрязва и остатъкът се секретира от панкреаса (остатъкът е самият инсулин). Нивото на C-пептида служи за мярка на това колко добре функционира задстомашната жлеза, а нивата на пептида обикновено спадат с времето при страдащите от диабет тип 1. В края на изпитването учените са наблюдавали повишение на продукцията на C-пептид при третираните с плазмида участници, а при контролната група нивото му спаднало, в сравнение с това, което е било отчетено в началото на изпитването. Подозираме, че това показва подобрение във функцията на бета-клетките при третираните пациенти. Бета-клетките, които са увредени, но все още не са разрушени, могат да възстановят функцията си, когато се прекрати атаката на имунната система към тях. В допълнение, с покачването на нивото на C-пептида, се наблюдавало съответно понижение на количеството на цитотоксичните Т-клетки, които разпознават проинсулина.
Важно е да се отбележи, че не са били засегнати Т-клетки, които отговарят на други антигени. Това предполага, че ефектът на плазмида е антиген-специфичен; постига се толерантност към проинсулина без да се изменя имунният отговор към вирусни антигени или други антигени на островчетата. В момента изследователите планират да проведат изпитване, при което деца, страдащи от диабет тип 1, да получават седмична доза от плазмида в продължение на година. Предклиничните изследвания показват, че същият подход, основан на плазмид, може да осигури толерантност и към други антигени на островчетата, включително глутамат декарбоксилаза, специфична за островчетата глюкозо-6-фосфатаза и цинков транспортер. Въпреки че при диабет тип 1 основно се атакува проинсулинът, тези молекули може също да играят роля в заболяването и също да бъдат поставени под прицел при лечението.
Друга вълнуваща стратегия за лечение на автоимунните заболявания цели индуцирането на регулаторни клетки, което може да потисне нежелана имунна активност. Регулаторните Т-клетки играят важна роля в потискането на имунните отговори. Увеличаването на количеството на подобни регулаторни имунни клетки може да осигури нов път към потушаване на автоимунния отговор при диабет тип 1.
В предклиничните експерименти с проинсулиновия плазмид, например, NOD-мишките започнали да произвеждат регулаторни Т-клетки, които секретирали интерлевкин-10 (вид цитокин, който потиска имунния отговор), когато са стимулирани с плазмида. За да се възползват от този естествен механизъм за контрол на имунната система, Jeffrey Bluestone от Университета на Калифорния, Сан Франциско, и колегите му изолирали Т-регулаторни клетки от 14 пациенти, страдащи от диабет тип 1, увеличили клетките в лабораторията и ги върнали обратно в пациентите. Не са били наблюдавани значителни странични ефекти, а при някои от участниците понижението на нивата на С-пептида се забавило, което продължило през следващите до 2 години след лечението.
Други терапии в етап на клинично проучване за диабет тип 1 имат за цел да повишат броя на регулаторните Т-клетки в панкреаса. Но до момента, всички тези опити са се фокусирали на Т-регулатори, които не са генерирани в отговор на специфичен антиген. Така, както вече съществуващите лечения на автоимунни заболявания, подобни терапии може да повишат риска от инфекции, като засягат широк кръг имунни клетки. Сега изследователите работят за подобряване на този подход, за да се прицелят в регулаторна клетка, която отговаря само на бета-клетките на панкреаса.
По-рано тази година Pere Santamaria, от Университета на Калгари, и колегите му изпробваха подобна насочена терапия при различни миши модели на автоимунност. Изследователите използвали наночастици, покрити със съответните автоимунни пептиди и части от главния комплекс за тъканна съвместимост, който обикновено подпомага активирането на цитотоксичните Т-клетки. Без допълнителни ко-стимулаторни сигнали, тези наночастици предизвикали in vivo диференциация на Т-клетките, които реагират срещу собствения за организма антиген, в антиген-специфични регулаторни Т-клетки. В животински модели, наночастиците потиснали симптомите на различни модели на автоимунни заболявания, включително диабет. Ако тези резултати се потвърдят и при човека, терапиите, чиято цел е да повишат нивата на съответните регулаторни Т-клетки, биха послужили за друг тип антиген-специфичен подход за потушаване на аномалните имунни отговори, които измъчват пациентите с диабет тип 1.
Други автоимунни заболявания
Всичко това ни дава надежда, че антиген-специфичният подход може да бъде подходящ за лечението на други автоимунни заболявания, за които не са известни подлежащите механизми. Благодарение на много години лабораторен труд и напредъка в разбирането ни за човешката имунна система, сега има няколко заболявания, за които се изясняват тези детайли.
Например, при голямата част от страдащите от миастения гравис (заболяване, което се характеризира с мускулна слабост и лесна уморяемост) имунната система генерира антитела, които атакуват рецептора за ацетилхолин от страната на мускула в синапса между моторните неврони и мускулните клетки. Подобни антитела са силно патогенни; бременна жена, която страда от заболяването, може да роди бебе със същото заболяване, поради предаване на такива антитела през плацентата. Доставянето на ацетилхолинов рецептор (AChR) в тялото на пациента, без необходимите ко-стимулаторни фактори, които да предизвикат имунен отговор, може да направи имунната система толерантна към този антиген и да намали или да спре продукцията на болестотворните антитела срещу AChR. И наистина, инжектирането на AChR-кодиращ плазмид, разработен от Tolerion, намалява тежестта на заболяването в животински модел на миастения. Други подходи, включващи въвеждане на пептидни фрагменти от AChR в носа на животното, също са ефективни. Въпреки обещаващите резултати, нито една терапия не е стигнала до етап клинично проучване.
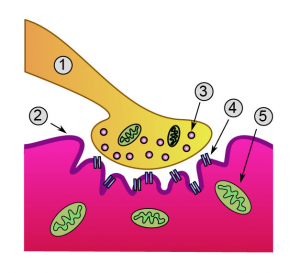
Схема на синапс: 1. Аксон; 2. Мембрана на мускулната клетка; 3. Синаптично мехурче, което носи ацетилхолина; 4. Рецептор за ацетилхолин (AChR); 5. Митохондиря. Credit: Dake (CC BY-SA 3.0)
Имало е няколко изпитвания на антиген-специфична терапия за множествена склероза. Няколко научни екипа са проектирали терапии за „толеризиране” на пациенти с това заболяване към различни белтъци от миелиновата обвивка, която обгражда аксоните на нервите в главния и гръбначния мозък и бива нападана от имунната система. Но просто не се знае кои от всички тези протеини предизвикват автоимунния отговор. Може би не е изненадващо, че ранните клинични изпитвания са дали разочароващи резултати.
За съжаление, тези провали вероятно са подсилили нежеланието на фармацевтичната индустрия да подпомогне разработването на антиген-специфични терапии за автоимунните заболявания. Още веднъж, можем да се поучим от историята. Противостоенето срещу разработката на Gleevec през 90-те години беше ожесточено, забавяйки клиничните изпитвания с близо пет години. Компанията, която разработваше лекарството, Ciba Geigy (сега Novartis), в началото не искаше да допусне медикамента до клиниката, като притесненията варираха от потенциалната токсичност на Gleevec до малкия пазар. Днес, фармацевтичната индустрия има сходни притеснения, когато ѝ се представят разработващи се антиген-специфични терапии за автоимунни заболявания.
Откривателите на Gleevec – Brian Druker и Charles Sawyers се пребориха с това противостоене и убедиха фармацевтичната индустрия да продължи разработката на лекарството. Резултатите в клиниката бяха впечатляващи, като пациентите, страдащи от хронична миелогенна левкемия, не просто не губят живота си, поради своето смъртоносно заболяване, а се радват на дълги ремисии. Щом ключовите антигени за дадено автоимунно заболяване бъдат открити, учените трябва да се възползват от това и да разработят антиген-специфични терапии за това заболяване. Вероятно така ще постигнат подобни зашеметяващи резултати.