През 2004 британският химик Крис Добсън спекулира, че може да съществува универсален еликсир, който да се пребори не само с алфа-синуклеина при болестта на Паркинсон, но и с амилоидите, които се образуват при множество заболявания, свързани с погрешно нагъване на протеините. Забележителното е, че същата година израелският учен Бека Соломон откри един необичаен кандидат за този еликсир – микроорганизъм, наречен фаг.
Соломон е професор в Университета на Тел Авив. Тя направила откритието си, когато изпитвала нов нов клас агенти срещу болестта на Алцхаймер. При успех, това ще даде началото на края на Алцхаймер, Паркинсон и много други невродегенеративни състояния. Историята е удивителна, но главният герой не е нито Соломон, нито който и да било друг учен, а скромният вирус, наречен М13.
Сред многобройните вариации на вирусите, има една, която инфектира бактерии. Известни като бактериофаги или просто фаги, тези микроорганизми се срещат навсякъде – от дъното на океана до стомаха на човека. Целта на М13 е да инфектира само един вид бактерия – Escherichia coli, която може да бъде открита в огромни количества в червата на бозайниците. Като други микроорганизми, М13 има само една цел – да предаде гените си нататък. За да направи това, той притежава оръжия, които да му позволят да навлезе в клетката, да я завладее и дори да я убие. Преди появата на антибиотиците, всъщност лекарите понякога използвали фаги, за да се борят с иначе нелечими бактериални инфекции.
За да разберете интереса на Соломон към М13, е необходима малко повече информация за предишните и проучвания. Тя е водещ изследовател на Алцхаймер, известна с това, че е пионер в т. нар. имунотерапевтично лечение на болестта. Имунотерапията включва специално приготвени антитела, вместо лекарствени вещества, които се насочват към плаките и сплетенията, причинени от болестта. Антителата са молекули, с формата на Y, които са част от естествената защита от инфекции. Те се свързват с нашествениците и подпомагат унищожаването им от имунната система. Но от 70-те години на 20-ти век, учените са в състояние да използват генното инженерство за създаване на изкуствени антитела, които нападат нежелани натрапници, като раковите клетки. През 90-те години Соломон решава да докаже, че такива антитела могат успешно да нападат бета-амилоидните плаки при Алцхаймер.
През 2004 тя провеждала експеримент върху група мишки, които били генетично модифицирани да развият такива плаки в мозъка си. Тя искала да провери дали изкуствените антитела, въведени през носа на животните, ще успеят да преминат през кръвно-мозъчната бариера и да разградят бета-амилоидните плаки в мозъка. В търсене на начин да вкара повече антитела в мозъка на мишките, Соломон решила да ги прикрепи към фаги М13, с надеждата, че двете заедно ще успеят по-добре да преминат кръвно-мозъчната бариера, да разградят по-голяма част от плаките и да подобрят състоянието на мишките, което се измерва чрез способността им да преминават през лабиринти и да решават други подобни задачи.
Соломон разделила гризачите на три групи. На една от тях тя дала само антитялото. Втората група получила комбинацията от антитяло и фаг, а като контрола използвала третата група, на която дала само фага.
Тъй като М13 не може да инфектира други организми, освен E. coli, тя очаквала, че контролната група животни няма да бъде повлияна по никакъв начин от него. Но за голяма изненада, самият той се оказал изключително ефективен в способността си да разгражда бета-амилоидните плаки, като подобрил познавателните способности на мишките, както и обонянието им. Соломон повторила експеримента отново и се случило същото нещо. Когато тя и екипът ѝ изследвали мозъците на мишките, те установили, че плаките са разградени в голяма степен. Соломон провеждала експеримента в продължение на година и открила, че третираните с фага мишки имали с 80% по-малко плаки от останалите. Тя нямала ясна представа как може фагът да разгражда тези плаки, но решила да патентова терапевтичните му свойства.
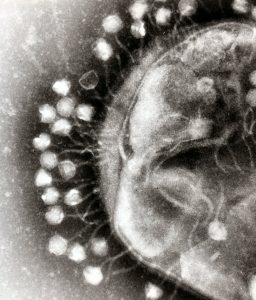
Фаги, нападащи бактериална клетка. Credit: microbiologybytes; flickr
На следващата година, синът на Соломон – Джонатан Соломон, който работил повече от десетилетие за специалните части на Израел и през това време получил бакалавърска степен по физика и магистърска по електроинженерство – отпътувал за Бостън, за да се запише в Бизнес училището на Харвард. През цялото време той не могъл да спре да мисли за фага, който майка му проучвала и за потенциала му да лекува ужасни болести като Алцхаймер. В Харвард срещнал много блестящи кандидат-предприемачи, включително Хампус Хилерщром, който, след като учил в Университета Св. Гален до Цюрих, работил за компанията HealthCap.
След първата година в бизнес училището, и двамата се включили в летни стажове – Соломон в производителя на медицински устройства Medtronic, а Хилерщром във фармацевтичния гигант AstraZeneca. Но, както Хилерщром си спомня, те се завърнали в Харвард с желание за нещо повече: „И двамата бяхме прекарали… бих го нарекъл „странно лято“ в големи компании и си казахме, че искаме да се заемем с нещо по-динамично и интересно“.
По време на втората година, Соломон и Хилерщром посетили учебен курс, в който на студентите била дадена задача да създадат нова компания на хартия. Курсът бил наречен „полево проучване“ и студентите трябвало да изследват нова технология или бизнес идея сами, но под ръководството на професор от бизнес училището. „Затова, предложих на Хампус да започнем нова компания, свързана с фага М13. В края на този семестър, ние развихме мини бизнес план. И се разбирахме толкова добре, че решихме да опитаме да го реализираме“ – разказва Соломон.
През 2007, със 150 000 долара начален капитал, събран с помощта на семействата им, се родила компанията NeuroPhage Pharmaceuticals. След договаряне на лиценза с Университета на Тел Авив за проучване на терапевтичните свойства на М13, Соломон и Хилерщром потърсили инвеститори, които биха заложили на потенциала на фага. До януари 2008 те успели да съберат над 7 милиона долара и започнали да назначават персонал.
Първият им служител – генералният научен директор на NeuroPhage – бил Ричард Фишър, ветеран от пет нововъзникнали биотехнологични компании. Фишър признава, че не се чувствал убеден, когато за първи път чул за чудодейния фаг. Но той много харесал Соломон и Хилерщром и решил, че за година ще успеят да разберат дали свойствата на М13 са реални или не.
Фишър решил да повтори експериментите на Бека Соломон и установил, че фагът наистина разгражда бета-амилоидните плаки, когато е въведен през носа на мишките. През следващите две години, Фишър и колегите му открили нещо напълно неочаквано: скромният фаг бил способен да унищожава и други амилоидни агрегати – неврофибриларни възли от тау-белтък, които се образуват при Алцхаймер, както и други амилоидни плаки, свързани с различни заболявания, включително алфа-синуклеин (Паркинсон), хънтингтин (болест на Хънтингтън) и супероксид дисмутаза (амиотрофна латерална склероза). Фагът бил ефективен и при разрушаването на амилоидите при болести, причинени от приони (клас, който включва болестта на Кройцфелд-Якоб). Фишър и колегите му демонстрирали това първо в епруветка, а след това в редица експерименти с животни. Изумително, простият вирус М13 изглежда притежавал свойствата на универсалния еликсир от представите на химика Крис Добсън.
Според тау-хипотезата за развитие на Алцхаймер, изменение в тау-белтъка го кара да се свързва с други нишки от същия белтък и да образува сплитания вътре в клетките на невроните, което разрушава транспортната система на клетката и в крайна сметка води до смъртта ѝ.
Уникалната способност на фага да атакува множество мишени привлякла нови инвеститори през 2010. Соломон чувствал радост, но и съмнение: „Имахме нещо интересно, което напада множество мишени, но нямахме никаква представа как работи.“
Ключът
Това не бил единственият им проблем. Терапевтичният им продукт – жив вирус – се оказал много труден за производство. Не било ясно и как да се доставят достатъчни количества от вирусни частици при лечението на човека. Методите, използвани при животинските модели – вдишване през носа или инжектиране директно в мозъка – били неприемливи, затова най-добрата опция изглежда било интратекално инжектиране в гръбначния канал.
Докато Соломон и Хилерщром се притеснявали как ще намерят приемлив път за въвеждане на фага в пациента, Фишър прекарвал дълги часове в опити да разбере какви са механизмите му на действие. „Защо един фаг би правил това с амилоидите? Наистина нямахме представа, но под микроскоп фагът много приличаше на амилоидна нишка, имаше същите размери.“
Бостън е град с огромни научни ресурси. На по-малко от миля от офиса на NeuroPhage се намира MIT – световен център на науката и технологиите. През 2010 Фишър наел Раджараман Кришнан – индийски млад учен, който работел в лаборатория към MIT, занимаваща се с изучаване на погрешното нагъване на белтъците. Кришнан споделя, че е бил много заинтригуван от работата с М13. Той започнал опити да разработи нови биохимични методи за изучаване на вируса и прочел огромно количество научна литература за фагите. Оказало се, че учените знаят доста за М13. Вирусолозите дори били създали библиотеки на мутантните форми на фага. Провеждайки редица експерименти, за да провери кои мутанти се свързват с амилоидите и кои не, Кришнан открил, че специалните способности на фага се дължат на няколко протеина, разположени върху повърхността му и наречени GP3. “Изпробвахме различни варианти на фаги със или без такива протеини и установихме, че когато липсват или ги изменяме, способността на фага да се свързва към амилоидите спада” – казва Кришнан.
Оказало се, че вирусолозите са установили структурата на вируса, използвайки рентгенова кристалография и ядрен магнитен резонанс. Анализирайки тези структури, микробиолозите предположили, че в природата фагът използва тези протеини като молекулярни ключове – те позволявали на вируса да „отключва” клетките на E. coli и да инжектират своята ДНК в тях. През 2011 Кришнан се убедил, че фагът прави нещо подобно, когато се свързва с амилоидните агрегати. Той предположил, че тайната на М13 се крие изцяло в GP3.
Както Фишър отбелязва, „въпрос на чист късмет е, че ключовете на М13 отключват не само E. Coli, но действат и при струпвания от неправилно нагънати белтъци.” Вероятността подобно нещо са се случи, казва Фишър, е много малка. „Вирусите притежават невероятна специфичност на молекулярните си механизми, защото се конкурират… необходимо е ключът и ключалката да си пасват идеално. А този единствен начин за навлизане в бактериалната клетка върши работа и при свързването с амилоидните плаки, които причиняват толкова много заболявания днес.”
Като доказали, че тайната на вируса се крие в няколко белтъка на повърхността му, Фишър, Кришнан и колегите им започнали да се питат дали не могат да намерят начин да въведат „лекарството” в пациента по безболезнен начин, а не епидурално. Затова, през следващите две години, учените от NeuroPhage създали ново антитяло (наречено фюжън протеин, защото е направено от генетичен материал от различни източници), което носело GP3 на повърхността си, за да може, както фага, да разгражда амилоидните плаки.
До 2013 учените от NeuroPhage изпробвали новото антитяло, наречено NPT088, в епруветки и върху животни, включително примати. Действието му било забележително – едновременно унищожавайки множество погрешно нагънати белтъци, като бета-амилоиди, тау-белтъци и алфа-синуклеин, намиращи се в различен етап от формирането на амилоидни плаки. Според Фишър, NPT088 не се свързва с нормално нагънати единични белтъци, включително нормалния алфа-синуклеин. Той се свързва само с погрешно нагънати протеини, като не просто ги разгражда, а дори блокира предаването им от клетка на клетка. Освен всичко това, антитялото може да се инжектира венозно.
Клинични изпитвания
През лятото на 2014, десет години след откритието на майка си, Соломон финализира плана си да въведе продукта в клиничната практика. Той споделя: „Сега имаме потенциално лекарство, което може да прави това, което и фагът, лесно е за производство и може да бъде въведено в организма венозно.”
 Ще бъде ли ефективно при човека? Въпреки че NPT088 относително трудно преминава кръвно-мозъчната бариера, тъй като е изградено от големи молекули, лекарството остава в тялото непроменено в продължение на няколко седмици. Затова Фишър смята, че във времето достатъчно от него достига до мозъка и оказва действието си. Антитялото може да бъде въвеждано в организма на пациента един или два пъти месечно интравенозно и колкото дълго е необходимо.
Ще бъде ли ефективно при човека? Въпреки че NPT088 относително трудно преминава кръвно-мозъчната бариера, тъй като е изградено от големи молекули, лекарството остава в тялото непроменено в продължение на няколко седмици. Затова Фишър смята, че във времето достатъчно от него достига до мозъка и оказва действието си. Антитялото може да бъде въвеждано в организма на пациента един или два пъти месечно интравенозно и колкото дълго е необходимо.
Сега NeuroPhage трябва да докаже, че продуктът им е безопасен и ефективен. До момента, NPT088 е доказано безопасен при примати. Но най-голямото изпитание ще бъде първата фаза (1А) от клиничното изпитване, което се очаква да започне тази година. Тази първа фаза ще включва еднократна доза при здрави доброволци, за да се провери дали ще настъпят някакви неблагоприятни странични ефекти. Ако всичко мине добре, NeuroPhage ще стартира фаза 1B, включваща около 50 пациента, болни от Алцхаймер, за да се демонстрира ефективността на лекарството. Мозъците им ще бъдат прегледани в началото, за да се определи количеството на бета-амилоиди и тау. След като са приемали лекарството в продължение на шест седмици, пациентите отново ще бъдат прегледани, за да стане ясно дали лекарството е повлияло агрегатите.
“Ако лекарството ни работи, това ще стане ясно по време на тези етапи от клиничното проучване” – казва Хилерщром. „След това можем директно да преминем към фаза 2 за Алцхаймер и Паркиносн.” Все още няма образна диагностика на алфа-синуклеин, но тъй като лекарството понижава нивата едновременно на бета-амилоиди, тау и алфа-синуклеин при животните, ако фаза 1В за Алцхаймер е успешна, това може да бъде достатъчно за Агенцията за контрол на храните и лекарствата (FDA).
Компанията трябва да докаже, че нейният продукт е по-добър от конкурентните. В момента има няколко лекарствени и биотехнологични компании, които са на етап клинични проучвания на продукти срещу Алцхаймер – както срещу бета-амилиодите (Lilly, Pfizer, Novartis, and Genentech) и тау (TauRx), така и срещу алфа-синуклеин при Паркинсон (AFFiRiS и Prothena/Roche). Но Соломон и Хилерщром смятат, че имат две предимства – активност срещу множество мишени (техният продукт е единственият, който е способен на това) и потентност (те смятат, че NPT088 унищожава повече токсични агрегати от конкурентните продукти). Потентността е проблем с голямо значение. Чрез позитронно-емисионна томография е установено, че съществуващите лекарства срещу Алцхаймер, като crenezumab, намаляват амилоидните товари много скромно – с едва около 10%. „Една от слабостите на съществуващите продукти” – казва Соломон –„е, че те само предотвратяват образуването на нови агрегати. Необходимо е и лекарство, което да е достатъчно активно, за да разрушава вече съществуващите.”
Бъдещи цели
Биотехнологичният бизнес е изключително рисков. В крайна сметка, може да се окаже, че NPT088 не е безопасен. И може да не е достатъчно активен. Дори той да понижава нивата на алфа-синуклеин, бета-амилоидите и тау, е възможно това да не доведе до измерими ефекти при хората, за разлика от животинските модели.

Credit: Ann Gordon, flickr
Но ако работи, както Соломон казва, това лекарство ще промени света: „Едно вещество, което ефективно лекува Алцхаймер и Паркинсон, може да носи по 20 милиарда долара годишно.” А в бъдеще, модифицирана версия би могла да лекува болестта на Хънтингтън, амиотрофичната латерална склероза, болестта на Кройцфелд-Якоб и други.
Попитах Джонатан за майка му, която даде старт на тази забележителна история през 2004. Според него, тя сега се занимава с други неща. „Майка ми, Бека Соломон, си остава истински учен. Правейки това вълнуващо научно откритие, тя с удоволствие остави по-малко интересната част – довеждането на продукта до клиниката – на нас. Сега тя е в търсене на следващото голямо откритие.”